 28.04.2016
28.04.2016
«Коммерсант» - Приложение Здравоохранение
Противостояние Минздрава и зарубежных фармацевтических компаний продолжается уже шесть лет: производители лекарств последовательно выступают против нормы закона, которая обязывает иностранных производителей проводить локальные клинические исследования в России даже в случае, если их препарат уже прошел испытания в ЕС и США, но без участия российских пациентов. Фармкомпании находят эту норму дискриминационной по территориальному признаку, поскольку такое условие ограничивает доступ российских пациентов к высокоэффективным инновационным препаратам, которые не продаются в России.
Избыточные нормы
Главный герой основанного на реальных событиях фильма "Далласский клуб покупателей" в борьбе с властями и ВИЧ-инфекцией доказал в суде, что может лечиться не зарегистрированным в США лекарством. В итоге, обыграв систему, он смог продлить себе жизнь на семь лет.
Сюжет о трудностях получения уже существующих в других странах лекарств пока не привлек внимания российских режиссеров. Возможно, потому, что в России все же есть возможность лечиться незарегистрированным препаратом. Получить его, однако, непросто: нужно решение врачебной комиссии и выданное Минздравом разрешение на его ввоз. Такие разрешения выдаются в срок, не превышающий пяти дней, заверили "Ъ" в Минздраве.
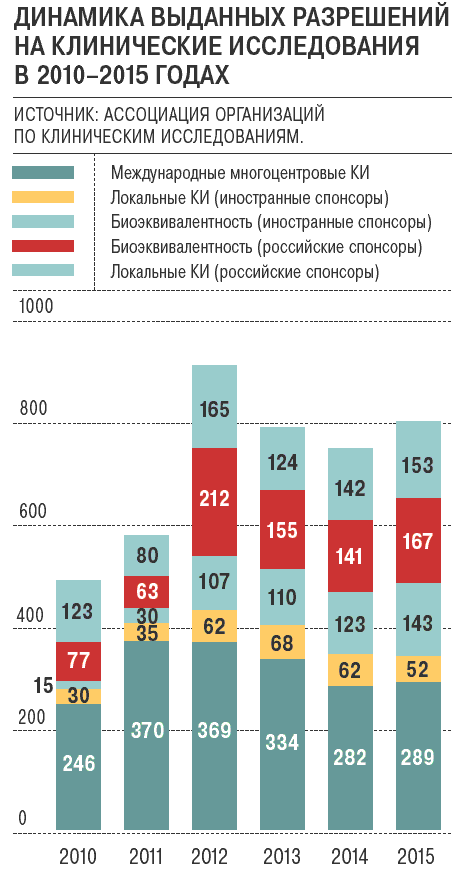
Впрочем, ситуация может усложниться и стать вполне кинематографичной, поскольку число международных клинических исследований (это исследование лекарств на людях) в России в последние годы почти не растет и находится на уровне 2005 года. А ведь закон "Об обращении лекарственных средств" с 2010 года признает результаты международных многоцентровых клинических исследований для регистрации препарата в России только в том случае, если в них участвовали российские центры. Это означает, что если российские пациенты не принимали участия в международных испытаниях, то лекарство, пусть и зарегистрированное в США — в Управлении по контролю качества пищевых продуктов и лекарственных препаратов (FDA) — и Европейском медицинском агентстве (EMA), не может быть допущено к регистрации в России. Чтобы попасть на российский рынок, фармкомпании должны проводить дополнительные клинические исследования с участием "российской популяции". Норма о взаимном признании, замечают как производители, так и эксперты, ни разу не была применена, поскольку клинические испытания признаются не на межгосударственном уровне, а на уровне фармкомпаний.
Аргументированное противостояние
Сп
ор о признании международных исследований зарубежные фармкомпании и Минздрав вед
ут все шесть лет, прошедших со времени принятия закона. "Позиция AIPM (Ассоциации международных фармацевтических производителей.— "Ъ") по данному вопросу последовательна и неизменна: мы против этой дискриминационной по территориальному признаку нормы, ограничивающей доступ российских пациентов к высокоэффективным инновационным препаратам",— заявил "Ъ" исполнительный директор AIPM Владимир Шипков.Фармкомпании, доводя свою позицию до чиновников, нашли союзника в лице Федеральной антимонопольной службы (ФАС). Уже несколько лет подряд ее глава Игорь Артемьев выступает за максимальное упрощение процедуры регистрации и признание в России зарубежных клинических исследований. Американское FDA и европейское EMA уже давно, по мнению ФАС, имеют "репутацию регуляторов, которые в состоянии обеспечить подтверждение качества и безопасности". В последнем письме премьеру Дмитрию Медведеву глава ФАС в начале текущего года изложил главные аргументы: требование о дополнительных исследованиях нарушает принцип равенства хозяйствующих субъектов. Минздрав, по-прежнему не доверяя международным исследованиям, аргументацию ФАС выслушал, но свою позицию не изменил. Разговоры же вокруг очередного письма ФАС в ведомстве Вероники Скворцовой тогда назвали "истерией", при этом подчеркнув, что случаев, когда препаратам чинились бы препятствия при выводе на рынок, не зафиксировано. "Внесение дополнительных изменений в законодательство в данной части в настоящий момент представляется нецелесообразным",— сообщили "Ъ" в Минздраве по итогам обсуждения письма Игоря Артемьева в министерстве.
Опрошенные "Ъ" фармкомпании настойчиво продолжают приводить свои доводы, главный из которых, что регистрация новых препаратов затягивается до пяти лет. По мнению медицинского директора Merz Russia Ларисы Чередеевой, проведение дополнительных локальных исследований отражается не только на сроках вывода препаратов на рынок, но и на стоимости их регистрации, а в конечном счете — на отпускной цене. "В этой ситуации многие производители могут отказаться от планов регистрации продукта в РФ, а это в первую очередь удар по пациентам",— соглашается с ней директор "Мерк Биофарма" в России и СНГ Роджер Янссенс.
Хотя локальные исследования дешевле международных в сотни раз, для компании это все-таки солидные траты. Директор "АстраЗенека" по клиническим исследованиям по региону "Россия и Евразия" Константин Гудков отмечает, что они могут стоить несколько миллионов долларов. "Несложно предположить, что не все компании смогут изыскать соответствующий бюджет, особенно это касается небольших инновационных биотехнологических компаний, а также препаратов с невысокой ожидаемой прибылью",— добавляет он. Стоимость локального исследования на фармрынке оценивают в $5-50 млн, международных — до $2 млрд.
Качество по российским стандартам
Другие аргументы зарубежных фармкомпаний против дополнительных испытаний — низкая научная обоснованность и отсутствие новизны полученных данных в ходе локальных исследований. Это требование изначально вводилось, напоминают в AIPM, как мера, которая могла бы стать барьером для выхода на рынок сомнительных, недобросовестных игроков. Однако все получилось наоборот: качество российских клинических исследований страдает, их результаты часто подделывают недобросовестные компании. По мнению иностранных фармкомпаний, это требование дискредитирует саму идею проведения клинических исследований.
В Ассоциации организаций по клиническим исследованиям (АОКИ) эту позицию поддерживают, называя регистрационные исследования неэтичными и "профанацией", а их ценность с научной точки зрения оценивают как нулевую. "Целеполагание у компаний разное: одно дело — пройти действительно жесткий контроль, чтобы выйти на международный рынок, другое дело — формально удовлетворить российского регулятора, принеся ему исследование, которое ничего не доказывает",— заявила "Ъ" глава АОКИ Светлана Завидова.
Отметим, что обязательные локальные исследования далеко не повсеместная практика. Аналогов этой нормы в законодательствах стран ЕС нет, а есть они преимущественно в азиатских странах, например в Японии. Раньше локальные испытания проводились в Северной Корее, но потом и там стали постепенно от них отказываться. В АОКИ уверены, что России нужно признать то, что признается всем миром: результаты клинических исследований, проведенных в соответствии с Guideline for Good Clinical Practice — руководством по надлежащей клинической практике. "Россия должна продолжить процесс гармонизации своей нормативно-правовой базы с соответствующими нормативами ЕС. В этом случае многие вопросы будут сняты. Кстати, по этому пути идут сейчас Казахстан, Грузия и Украина",— отмечает гендиректор национальной биофармацевтической компании ФОРТ Антон Катлинский.
В АОКИ говорят, что из-за отказа Минздрава признавать исследования ЕС и США фармотрасль, "вися у Минздрава на крючке, бродит по замкнутому кругу". "Если Россию не включают в международное исследование, то российские пациенты не получают препарата. Отсюда и возникают идеи принудительного лицензирования",— объясняет Светлана Завидова.
Дарья Николаева Подробнее:http://www.kommersant.ru/doc/2973282
 28.04.2016
28.04.2016
 ор о признании международных исследований зарубежные фармкомпании и Минздрав вед
ор о признании международных исследований зарубежные фармкомпании и Минздрав вед